①250 mL容量瓶 ②b ③97.5%
①250 mL容量瓶 ②b ③97.5%
发布时间:2025-09-05 19:55:10
①250 mL容量瓶 ②b ③97.5%
 4Fe(OH)3。②将FeCl2溶液高温水解、氧化也可直接制得氧化铁,需要有氧气参与反应,反应还生成HCl,反应方程式为4FeCl2 4H2O O2
4Fe(OH)3。②将FeCl2溶液高温水解、氧化也可直接制得氧化铁,需要有氧气参与反应,反应还生成HCl,反应方程式为4FeCl2 4H2O O2 2Fe2O3 8HCl。(2)高锰酸钾溶液具有强氧化性,将Fe2 氧化为Fe3 ,自身被还原为Mn2 ,反应的离子方程式为5Fe2 Mn
2Fe2O3 8HCl。(2)高锰酸钾溶液具有强氧化性,将Fe2 氧化为Fe3 ,自身被还原为Mn2 ,反应的离子方程式为5Fe2 Mn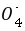 8H
8H  5Fe3 Mn2 4H2O,高锰酸钾溶液为紫色,当滴定到终点时,Fe2 被完全氧化,加入的最后一滴高锰酸钾溶液不反应,溶液的颜色变浅紫红色,不需要另外加入指示剂;步骤a,Fe2 被氧化为Fe3 ,所以事先取少量绿矾产品溶于水,滴加KSCN溶液进行验证,若溶液变红色,说明被氧化,否则未被氧化;①配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需250 mL容量瓶;②酸性高锰酸钾溶液具有强氧化性,盛放在酸式滴定管中,且向锥形瓶中滴加硫酸亚铁溶液,与空气接触增大,会被氧气氧化,导致误差增大,故b最合理;③n(Mn
5Fe3 Mn2 4H2O,高锰酸钾溶液为紫色,当滴定到终点时,Fe2 被完全氧化,加入的最后一滴高锰酸钾溶液不反应,溶液的颜色变浅紫红色,不需要另外加入指示剂;步骤a,Fe2 被氧化为Fe3 ,所以事先取少量绿矾产品溶于水,滴加KSCN溶液进行验证,若溶液变红色,说明被氧化,否则未被氧化;①配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需250 mL容量瓶;②酸性高锰酸钾溶液具有强氧化性,盛放在酸式滴定管中,且向锥形瓶中滴加硫酸亚铁溶液,与空气接触增大,会被氧气氧化,导致误差增大,故b最合理;③n(Mn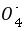 )=0.010 00 mol/L×0.02 L=2×10-4 mol,由5Fe2 Mn
)=0.010 00 mol/L×0.02 L=2×10-4 mol,由5Fe2 Mn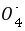 8H
8H  5Fe3 Mn2 4H2O,可知n(Fe2 )=5×2×10-4 mol=1×10-3 mol,所以250 mL溶液中含有n(Fe2 )=1×10-3 mol×
5Fe3 Mn2 4H2O,可知n(Fe2 )=5×2×10-4 mol=1×10-3 mol,所以250 mL溶液中含有n(Fe2 )=1×10-3 mol×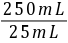 =1×10-2 mol,则m(FeSO4·7H2O)=278 g/mol×1×10-2 mol=2.78 g,样品中FeSO4·7H2O的质量分数为
=1×10-2 mol,则m(FeSO4·7H2O)=278 g/mol×1×10-2 mol=2.78 g,样品中FeSO4·7H2O的质量分数为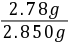 ×100%≈97.5%。
×100%≈97.5%。
