[化学——选修3:物质结构与性质]
[化学——选修3:物质结构与性质]
发布时间:2025-07-29 15:47:05
[化学——选修3:物质结构与性质]
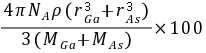 [知识点] 核外电子排布、电离能、原子半径、杂化轨道、空间构型以及晶胞结构判断与计算等[考查能力]分析和解决(解答)化学问题的能力、接受、吸收、整合化学信息的能力[解析]试题分析:(1)As的原子序数是33,则基态As原子的核外电子排布式为1s22s22p63s23p63d104s24p3。(2)同周期自左向右原子半径逐渐减下,则原子半径Ga大于As,由于As的4p轨道电子处于半充满状态,稳定性强,所以第一电离能Ga小于As。(3)AsCl3分子的价层电子对数=3
[知识点] 核外电子排布、电离能、原子半径、杂化轨道、空间构型以及晶胞结构判断与计算等[考查能力]分析和解决(解答)化学问题的能力、接受、吸收、整合化学信息的能力[解析]试题分析:(1)As的原子序数是33,则基态As原子的核外电子排布式为1s22s22p63s23p63d104s24p3。(2)同周期自左向右原子半径逐渐减下,则原子半径Ga大于As,由于As的4p轨道电子处于半充满状态,稳定性强,所以第一电离能Ga小于As。(3)AsCl3分子的价层电子对数=3 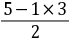 =4,即含有一对孤对电子,所以立体构型为三角锥形,其中As的杂化轨道类型为sp3。(4)由于GaF3是离子晶体,GaCl3是分子晶体,所以离子晶体GaF3的熔沸点高;(5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示,熔点很高,所以晶体类型是原子晶体,所以Ga与As以共价键结合,根据晶胞计算Ga与As个数均是4个,所以晶胞的体积V=4/NA(MGa MAs )/ρ所以GaAs晶胞中原子的体积占晶胞体积的百分率为
=4,即含有一对孤对电子,所以立体构型为三角锥形,其中As的杂化轨道类型为sp3。(4)由于GaF3是离子晶体,GaCl3是分子晶体,所以离子晶体GaF3的熔沸点高;(5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示,熔点很高,所以晶体类型是原子晶体,所以Ga与As以共价键结合,根据晶胞计算Ga与As个数均是4个,所以晶胞的体积V=4/NA(MGa MAs )/ρ所以GaAs晶胞中原子的体积占晶胞体积的百分率为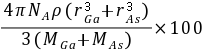 [难度]中等[题分]15分
[难度]中等[题分]15分
